CITOESQUELETO
Silvia Márquez – Lionel Valenzuela Pérez – Sergio D. Ifrán – Maria Elena Pinto
Introducción
El citoesqueleto es propio de las células eucarióticas. Es una estructura tridimensional dinámica que se extiende a través del citoplasma. Por lo tanto la idea de que el citoplasma de la célula es una masa amorfa y gelatinosa es equivocada.
Esta matriz fibrosa de proteínas se extiende por el citoplasma entre el núcleo y la cara interna de la membrana plasmática, ayudando a definir la forma de la célula e interviniendo en la locomoción y división celular. Es decir que el citoesqueleto no sólo da estabilidad a la célula como un esqueleto, sino que es también como el músculo interviene en el movimiento celular. Por lo tanto podríamos llamarlo también “citomusculatura”. Podemos agregar que el citoesqueleto condiciona el movimiento de las organelas del interior de la célula y tiene gran importancia metabólica, dando un andamiaje a los procesos moleculares que se realizan en el citoplasma.
El citoesqueleto es característico de las células eucariontes ya que ESTA AUSENTE EN LOS PROCARIONTES. Por lo que podría ser un factor esencial en la evolución de los eucariotas
De esta forma podemos enunciar las siguientes funciones del citoesqueleto:
Ø Estabilidad celular y forma celular
Ø Locomoción celular
Ø División celular
Ø Movimiento de los orgánulos internos
Ø Regulación metabólica
Sistemas de Filamentos
En los años 1950-1960, la microscopia electrónica consiguió sacar a luz tres sistemas distintos de filamentos del citoplasma. Estudios bioquímicos e inmunológicos posteriores identificaron el conjunto específico de proteínas que caracteriza a cada sistema de filamentos. Los tres sistemas primarios de fibras que componen el citoesqueleto son: microfilamentos, microtúbulos y filamentos intermedios.
Proteínas Accesorias
Estos sistemas primarios de filamentos (microfilamentos , filamentos intermedios y microtúbulos), están asociados a un conjunto de proteínas llamadas proteínas accesorias. Las proteínas accesorias cumplen distintas funciones y de acuerdo a estos roles se las clasifican en:
Ø Proteínas reguladoras: regulan los procesos de alargamiento (polimerización) y acortamiento (despolimerización) de los filamentos principales.
Ø Proteínas ligadoras: conectan los filamentos entre si y con distintas estructuras celulares
Ø Proteínas motoras: sirven para la motilidad, contracción y cambios de forma celulares. También trasladan macromoléculas y organoides de un punto a otro del citoplasma.
Microfilamentos
Son las fibras más delgadas de 3-6 nm (nanómetros=milmillonésimas de metro= 10-9), están formados por la proteína actina. La actina es una proteína con funciones contráctiles, es también la proteína celular más abundante. La asociación de estos microfilamentos de actina con la proteína miosina es la responsable de la contracción muscular. Los microfilamentos también pueden llevar a cabo los movimientos celulares, incluyendo desplazamiento, contracción y citiocinesis.
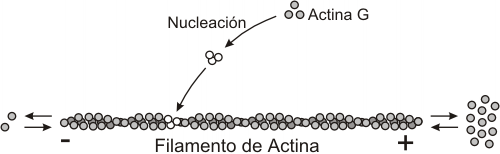
Fig. 6.1- Polimerización y despolimerización de los filamentos de actina. (a) actina G, (b) nucleación, (c) polimerización y despolimerización.
La actina es la proteína base de los microfilamentos. El monómero es conocido como actina G, o actina globular. En presencia de ATP, se polimeriza formando largas hélices dobles, denominadas actina F, o actina filamentosa. Para que se lleve a cabo esta polimerización el ATP debe convertirse en ADP, liberando la energía necesaria para el proceso. La actina, presenta polaridad, tiende a polimerizarse (alargarse) y despolimerizarse (acortarse) a gran velocidad por un extremo más (el extremo positivo), y a realizar los mismos procesos por el otro extremo, menos (extremo negativo), a menor velocidad.
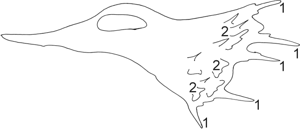
Fig. 6.2 - Esquema de una célula en movimiento. (1) Filopodios (prolongaciones digitiformes); (2) Lamelipodios (láminas citoplasmáticas)
Distribución celular
1. Filamentos Transcelulares (atraviesan el citoplasma en todas las direcciones).
2. Filamentos Corticales (por debajo de la membrana plasmática)
En las células epiteliales , los filamentos transcelulares transportan organoides, asociados a la proteína motora miosina I.
En las células del tejido conectivo los filamentos de actina transcelulares se llaman fibras tensoras y están asociadas a la proteína motora miosina II.
Los filamentos de actina cumplen un rol principal en la motilidad celular , decisiva en el desarrollo embrionario. En las células musculares los filamentos de actina no se acortan ni se alargan.
La droga citocalasina B provoca la despolimerización de los filamentos de actina, debido a que se une a sus dos extremos y bloquea su crecimiento.
Microtúbulos
Los microtúbulos son tubos cilíndricos de 20-25 nm de diámetro. Están compuestos de subunidades de la proteína tubulina , estas subunidades se llaman alfa y beta. Los microtúbulos actúan como un andamio para determinar la forma celular, y proveen un conjunto de “pistas” para que se muevan las organelas y vesículas. Los microtúbulos también forman las fibras del huso para separar los cromosomas durante la mitosis y la meiosis. Cuando se disponen en forma geométrica dentro de cilios y flagelos, son usados para la locomoción (autopropulsión) o para mover líquido circundante o partículas (motilidad).
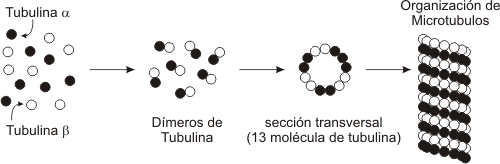
Fig. 6.4- Polimerización de la tubulina a partir de las tubulinas alfa y beta
Como mencionamos anteriormente la tubulina forma polímeros. La tubulina es una proteína globular, de la que existen dos polipéptidos distintos aunque similares, la alfa tubulina y la beta tubulina. La alfa y la beta tubulina se asocian y forman dímeros. En presencia de GTP, los dímeros de tubulina se unen y forman un tubo cuya parte central se mantiene vacía. Al igual que la actina F, los microtúbulos manifiestan polaridad, un extremo tiende a la polimerización o despolimerización a mayor velocidad (extremo +) y en el otro extremo ocurre lo mismo pero a menor velocidad (extremo).
Los microtúbulos se organizan a partir de centros organizadores especializados, que controlan su localización y orientación en cel citoplasma. El centro organizador principal en las células animales es el centrosoma, próximo al núcleo. El centrosoma esta formado por estructuras en forma de anillo que contiene otra tipo de tubulina, la gama tubulina. Estos anillos actuan como centros de nucleación (crecimiento) de microtúbulos. Los dímeros de tubulina se añaden al anillos de gama tubulina con una orientación específica, siempre el "extremo -" de cada microtúbulo queda dentro del centrosoma y el crecimiento se produce por el "extremo +" .

Fig. 6.5- Extremos + y - de un microtúbulo
Las proteínas asociadas a los microtúbulos reciben el nombre de proteínas MAP (proteínas asociadas a los microtúbulos).
Por su localización, podemos clasificarlos en:
1. Citoplasmáticos (célula en interfase)
2. Mitóticos (fibra del huso)
3. Ciliares (en el eje de los cilios)
4. Centriolares (en cuerpos basales y centríolos)
Los microtúbulos citoplasmáticos son necesarios como vías de transporte de macromoléculas y organoides (vesículas, mitocondrias, etc.), intervienen dos proteínas motoras quinesina y dineína. En la neurona existe otra proteína motora asociada a los microtúbulos, la dinamina.
También establecen la forma celular. En las neuronas se hallan en las dendritas y en el axón, donde son esenciales para el crecimiento de éste último, que depende del alargamiento de sus microtúbulos. Este alargamiento es dependiente de la proteína motora dinamina, que provoca el deslizamiento de los microtúbulos, unos sobre otros.
En las neuronas se ha descubierto una MAP reguladora, denominada tau, que estabiliza los microtúbulos. En la enfermedad de Alzheimer, caracterizada por el deterioro neuronal progresivo, esta alterado el funcionamiento normal de esta proteína y por lo tanto se ve incrementada la inestabilidad de los microtúbulos imposibilitando el transporte axónico.
Los microtúbulos mitóticos movilizan los cromosomas durante la mitosis y la meiosis.
Los microtúbulos de cilias y flagelos crecen a partir de un cuerpo basal o cinetosoma de estructura idéntica a la de un centrosoma que actua como centro de nucleación de dímeros de alfa-beta tubulina. El cuerpo basal se encuentra por debajo de la membrana plasmática.
Existen diversas drogas que afectan a los microtúbulos, por ejemplo, la colchicina que se une a las tubulinas e impide su polimerización, lo que en definitiva produce la despolimerización de los microtúbulos. También pueden hacerse desaparecer los microtúbulos mitóticos mediante el uso de las drogas vinblastina y vincristina, que actúan de forma semejante a la colchicina, pero en forma selectiva, sobre los microtúbulos del huso mitótico. Por lo tanto estas drogas bloquean la división celular. Otra droga que produce los mismos efectos es el taxol, que impide la despolimerización de los microtúbulos, lo que induce su crecimiento descontrolado volviéndose imposible la división celular.
Filamentos intermedios
Los filamentos intermedios tienen 10 nm de diámetro y proveen fuerza de tensión (resistencia mecánica) a la célula. Según el tipo celular varían sus proteínas constitutivas. Podemos decir que existen seis tipos de filamentos intermedios:
1) Neurofilamentos (en la mayoría de las neuronas).
2) Filamentos de desmina, en el músculo.
3) Filamentos gliales, en las células del mismo nombre , que sirven de soporte en el cerebro, médula espinal y sistema nervioso periférico.
4) Filamentos de vimentina en células del tejido conjuntivo y en los vasos sanguíneos.
5) Queratinas epiteliales, (o filamentos de queratina o también llamados tonofilamentos), en células epiteliales.
6) Laminofilamentos, forman la lámina nuclear, una delgada malla de filamentos intermedios sobre la superficie interna de la envoltura nuclear. Son los únicos que no se encuentran en el citoplasma.
A diferencia de los microfilamentos y microtúbulos, los filamentos intermedios al agruparse pierden polaridad, por lo tanto no presentan extremo + y extremo - (ver Fig. 6.6).
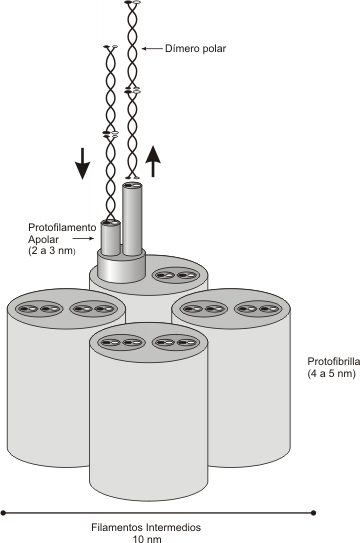
Fig. 6.6- Estructura de los filamentos intermedios
Distribución celular
Los filamentos intermedios forman redes que conectan la membrana plasmática con la envoltura nuclear, formando una red continua a su alrededor. Una red similar se encuentra en la cara interna de la envoltura (lámina nuclear).
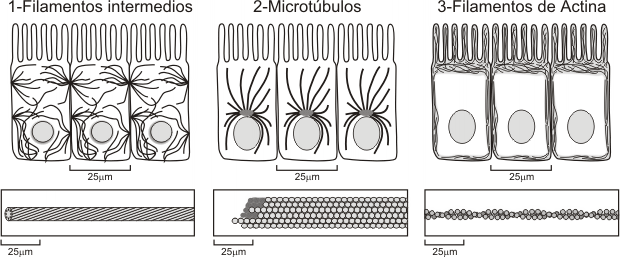
Fig. 6.7- Distribución de los componentes del citoesqueleto en la célula. 1- Filamentos intermedios unidos a desmosomas, 2- Microtúbulos partiendo del centrosoma, 3- Microfilamentos en el polo apical de la célula-(actina en microvellosidades).
Ejemplos de la función y estructura del citoesqueleto en células epiteliales
Motilidad y movimiento celular
La motilidad y movimiento celular se logra por medio de cilias y flagelos.
Las cilias son apéndices delgados, que surgen de la superficie de distintos tipos celulares. Los cilios de mayor longitud se llaman flagelos. Las estructuras ciliares se encuentran en epitelios especializados en eucariontes. Por ejemplo, las cilias barren los fluidos sobre células estacionarias en el epitelio de la tráquea y tubos del oviducto femenino (trompas de Falopio).
Los flagelos, son importantes para el movimiento celular. Son más largos que las cilias pero sus estructuras internas de microtúbulos son similares. Los flagelos procarióticos y eucarióticos poseen estructuras muy diferentes.
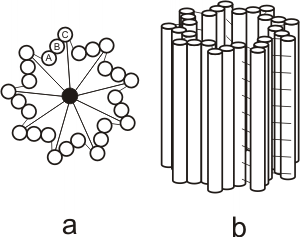
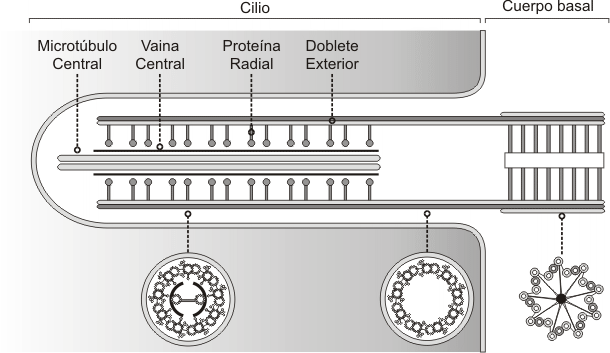
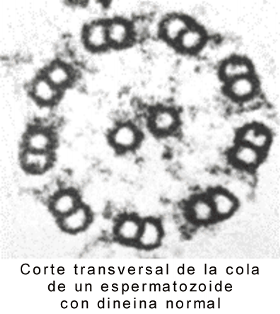
Ambos, flagelos y cilias tienen una disposición de túbulos de “9+2”. Esta disposición se refiere a los 9 pares fusionados de microtúbulos periféricos y de 2 microtúbulos no fusionados en el centro. Brazos de dineína sirven como motores moleculares (proteína accesoria motora). Si los brazos de dineína son defectuosos ( a causa de una mutación en los genes de la dineína), las cilias y los flagelos son inmóviles, lo que provoca problemas en el tracto respiratorio (bronquitis crónicas), e infertilidad en la mujer y el varón (flagelos de los espermatozoides inmóviles y cilias de las trompas uterinas inmóviles).
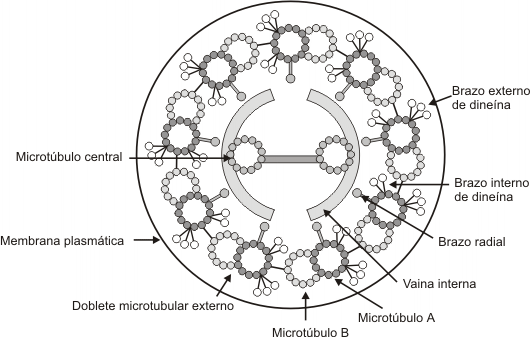
Fig. 6.10(a) - Esquema de un cilio (corte transversal)
 |
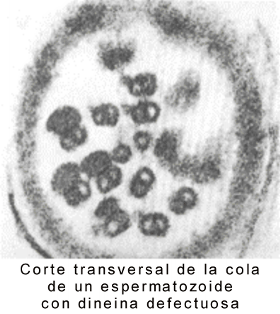 |
Fig. 6.10 (b) Microfotografías electrónicas del flagelo de un espermatozoide normal y con dineína defectuosa
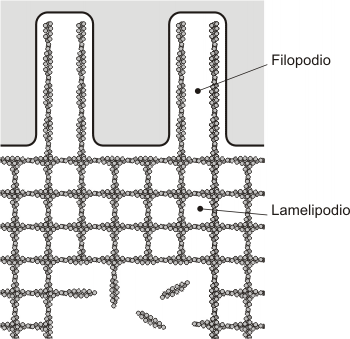
La célula en movimiento puede tomar también un aspecto poligonal por modificaciones en los filamentos de actina corticales, formándose láminas citoplasmáticas, llamadas lamelipodios con prolongaciones denominadas filopodios. Lamelipodios y filopodios alteran períodos de crecimiento y acortamiento, base de la motilidad celular.
Los axones crecen en su extremo distal por una especialización, llamada cono de crecimiento que responde a estímulos físicos y químicos.
Movimiento de organelos internos
Anteriormente hemos mencionado que el citoesqueleto actúa como un andamiaje sobre el cual, con la ayuda de las proteínas accesorias (como por ejemplo las proteínas motoras) es posible mover organelas, cromosomas, provocar flujos citoplasmáticos y lograr la división celular (citocinesis).
Para tener una visión mas precisa de estos y otros fenómenos celulares veremos como actúan las proteínas accesorias motoras.
Las proteínas accesorias motoras, son motores proteicos que ligan dos moléculas y que utilizando ATP , provocan el desplazamiento de una molécula con respecto a la otra. Estas proteínas tienen un extremo motor que unen al citoesqueleto (microtúbulos y actina) y por el extremo ligante pueden unirse a diferentes tipos de estructuras moleculares, como por ejemplo organelas, vesículas u otras proteínas del citoesqueleto.
Ejemplos de proteínas motoras:
Ø Miosina que se une a actina
Ø Quinesina o Kinesina que se une a microtúbulos
Ø Dineína que se une a microtúbulos
Cuando se conectan a otros microtúbulos, las proteínas motoras pueden causar movimiento si los extremos están fijos (cilias y flagelos) o extender la longitud de los paquetes de fibras si los extremos están libres.
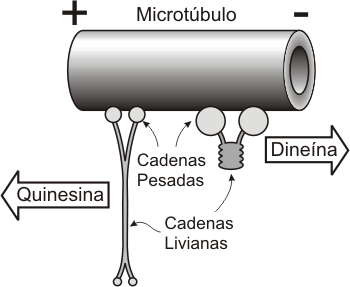
Fig. 6.11 - Movimiento de proteínas motoras sobre los microtúbulos
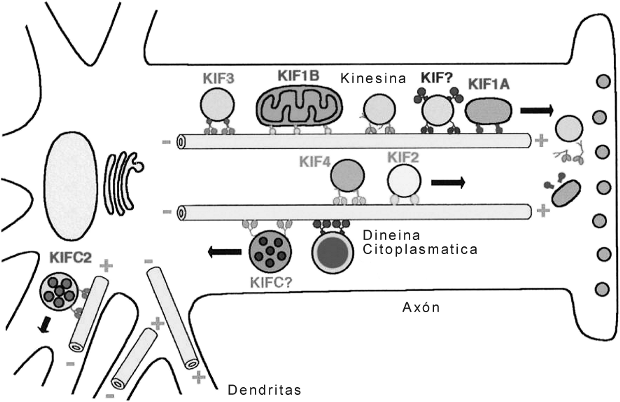
Fig. 6.12 - Disposición de los microtúbulos en el axón de una neurona. Observe los distintos tipos de transporte, uno anterógrado del cuerpo celular a la terminal sináptica y un transporte retrógrado, de la terminal al cuerpo celular. Los microtúbulos junto con las proteínas motoras transportan los distintos materiales, por ejemplo vesículas con neurotransmisores. (De Kinesin and Dynein Superfamily Proteins and the Mechanism of Organelle Transport. Nobutaka Hirokawa Science.279:519-526)
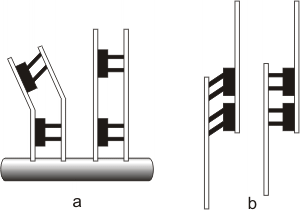
Fig. 6.13 - Microtúbulos asociados a proteínas motoras. (a) Los extremos fijos de los microtúbulos permiten a los motores proteicos mover las fibras. (b) Los extremos libres de los microtúbulos permiten a los motores proteicos extender la longitud de las fibras.
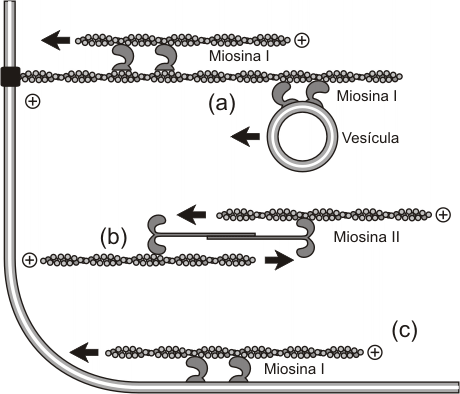
Fig. 6.14 - Asociaciones de las miosinas I y II con los filamentos de
actina. (a) Los filamentos de actina transcelulares (que atraviesan toda
la célula), sirven como vías de transporte para organoides
en el citoplasma. Para esto necesitan de la proteína motora miosina,
que consume ATP para provocar el movimiento. (b) En los filamentos de
actina que actuán como fibras tensoras, se localizan numerosas
unidades de miosina II. Estos filamentos de actina se unen a estructuras
localizadas en la membrana plasmática, llamadas contanto focales.
De esta forma se generan leves movimientos pero continuos
Matriz Extracelular
Bajo el nombre de matriz extracelular (MEC) se agrupan los elementos intercelulares presentes en los organismos pluricelulares. La composición de la MEC es única para cada tipo de tejido.
La MEC es un medio dinámico que juega un rol central en la regulación de las funciones celulares durante la remodelación y el crecimiento celular normal y patológico, como en el desarrollo embrionario y toda una serie de procesos que acontecen en el organismo adulto por ejemplo, la coagulación sanguínea, la curación de heridas, la inflamación, la reparación de tejidos dañados, y la erradicación de infecciones. Paradójicamente, la adhesividad a la MEC puede facilitar también, la aparición de artritis reumatoide, ataques cardíacos, los accidentes cerebro vasculares (ACV), la invasión tumoral y la metástasis.
Las células del cuerpo se mantienen pegadas unas a otras y a un material cohesivo extracelular (la MEC), que las circunda. Esta cohesión es esencial para la supervivencia, ya que mantiene unidos a los tejidos. Las células normales no logran sobrevivir si no están adheridas a algún tipo de sustrato o entre ellas.
Los componentes de la MEC pueden clasificarse en fluidos y fibrosos. Los componentes fluidos son los glicosaminglicanos (polisacárido) y proteoglicanos (glicoproteína). Por otro lado, los componentes fibrosos se dividen en proteínas estructurales (colágenos) y proteínas adhesivas (fibronectina, laminina).
Componentes Fluidos
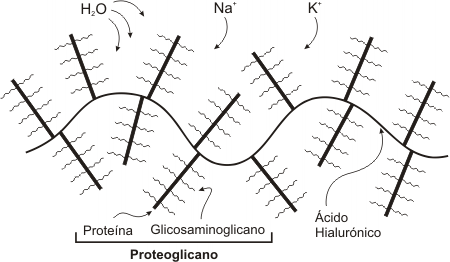
La MEC posee glicosaminoglicanos, un heteropolisacárido que se hallan asociados entre sí o a glicoproteínas llamadas proteoglicanos.
Los glicosaminoglicanos y los proteoglicanos se asocian entre sí formando agregados moleculares de gran tamaño. Estos agregados tienen un papel estructural debido a que presentan excelente resistencia mecánica a los golpes debido a sus propiedades viscoso elásticas.
Todos los glicosaminoglicanos, son moléculas ácidas con numerosas cargas negativas. Además, todos los glicosaminoglicanos, excepto el ácido hialurónico, poseen grupos sulfatos (también un grupo ácido). Por lo tanto podemos decir que el carácter ácido de los proteoglicanos y los glicosaminoglicanos, los conduce a fijar cationes (Na+, K+), en consecuencia constituyen una reserva de estos. Por otra parte los cationes están rodeados de agua, esto aumenta el volumen (turgencia) de la MEC. Debido a que los proteoglicanos retienen agua, son directamente responsables del grado de hidratación de la matriz extracelular (ver otros polisacáridos en Composición química de los seres vivos).
Componentes Fibrosos
Colágeno
Es un grupo de glucoproteínas fibrilares presentes en los tejidos conjuntivos. Existen varios tipos que se denominan con números romanas.
Principales tipos de colágenos:
Ø Tipo I: presente en la dermis, los huesos y en los tendones.
Ø Tipo II: presente en el cartílago.
Ø Tipo III: existe en la dermis
Ø Tipo IV: se encuentra en la membrana basal
La subunidad de colágeno, se llama tropocolágeno (tropos, en griego significa bastoncito). Está formado por tres cadenas polipeptídicas de 1050 aminoácidos cada una. Uno de cada tres aminoácidos es una glicina, seguido muy probablemente de una prolina o hidroxiprolina.
Cada cadena polipeptídica se denomina alfa. Por lo tanto deben unirse tres hélices alfa (alfa 1, alfa 2 y alfa 3), para formar el bastoncito de tropocolágeno.
Proteínas adhesivas: Fibronectina y Laminina
La fibronectina, es una glicoproteína encontrada en la mayoría de las matrices extracelulares en forma de agregados o fibrillas. Esta importante proteína adhesiva, cumple funciones que involucran procesos de adhesión, como la migración y la invasión celular. La fibronectina media una variedad de adhesiones uniéndose al fibrinógeno/fibrina (coagulación sanguínea), colágeno, heparán sulfato y al ácido hialurónico (Fig.6.16).
La laminina es una glicoproteina de adhesión que se encuentran en todas las membranas basales (se encuentra asociada al colágeno IV). La laminina cumple una función estructural muy importante. Participa en la migración, proliferación y diferenciación celular.
Es la primera proteína adhesiva que aparece en la MEC, durante el desarrollo embrionario.
Receptores de la matriz extracelular y moléculas de adhesión celular (MAC)
Son glicoproteínas transmembranosas que intervienen en el reconocimiento y la adhesión celular. Las moléculas de Adhesión se encuentran en la superficie celular y solo se unen a moléculas idénticas a ellas mismas (uniones homófilicas). Mediante las MAC (o CAM en inglés) la célula migratoria busca una célula del mismo tipo, para formar un tejido. (Cuadro 6.1)
Los receptores de la matriz extracelular, las integrinas [1] (glicoproteínas transmembrana heterodiméricas), forman parte de los denominados contactos focales. La integrina por sus dominios extracelulares se une a las fibras de colágeno a través de una proteína adhesiva, la fibronectina o laminina. Por sus dominios citosólicos se une a los filamentos de actina a través de un conjunto de proteínas ligadoras, como la talina, vinculina, paxilina y a-actinina. La unión de las integrinas es dependiente de calcio y magnesio.
|
Cuadro 6.1
- Moléculas de Adhesión calcio dependientes
|
||||
|
Tipo de Cadherina |
Localización |
Estructura |
Proteina intracelular de unión |
Filamento citoplasmático |
|
E-Cadherina P-Cadherina |
Células epiteliales |
Cinturón adhesivo |
Cateninas, a-actinina |
Actina |
|
Cadherina desmosomal |
Epidermis Placenta |
Desmosomas |
Desmoplaquinas I, II; Placoglobina |
Keratina; desmina |
|
N-Cadherina |
Nervio, músculo |
Cinturón adhesivo |
Cateninas, a-actinina, vinculina. |
Actina. |
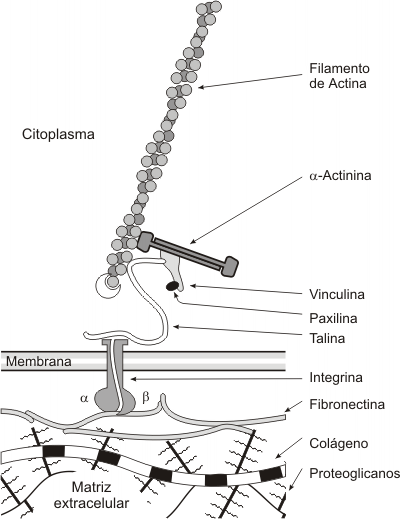
Fig. 6.16 - Integración del citoesqueleto con la matriz extracelular. Las integrinas que atraviesan la membrana plasmática, por uno de sus extremos se unen a moléculas de la MEC, en este caso fibronectina. Por el lado intracelular, se unen al citoesqueleto. La unión al citoesqueleto esta formada por el agregado molecular complejo (contacto focal)
Degradación y recambio de la matriz extracelular (MEC)
La degradación de la matriz extracelular y su recambio son importantes procesos en la remodelación de tejidos durante el desarrollo, curación de heridas, necrosis tumoral e inflamación. Factores clave del recambio de la matriz extracelular son las metaloproteasas de la matriz (MPM) y sus inhibidores. Estas moléculas degradan las moléculas de la matriz extracelular, proteoglicanos, glicoproteínas y varios tipos de colágenos. Las metaloproteasas son secretadas por las células en una forma inactiva (prometaloproteasa), activándose luego en la matriz, por una cascada de metaloproteasas.
Miniglosario:
Tejido conjuntivo: Constituye el compartimiento extracelular o matriz extracelular, en el que se encuentran sumergidas fibras y células especializadas. Las moléculas que se encuentran en esta matriz son sintetizadas en el interior celular. Este compartimiento, es muy importante pues constituye del 15-20 % del volumen del organismo según las especies.
Lamina o membrana basal: Se denomina membrana basal a una formación de membrana constituida por moléculas que pertenecen al tejido conjuntivo y que sostienen los epitelios y los endotelios. Esta membrana no es de naturaleza fosfolipídica sino glucoproteica.
DIFERENCIACIONES DE MEMBRANA
Se denominan diferenciaciones de membrana a las regiones de la membrana plasmática adaptadas a diferentes funciones, como la absorción, la secreción, el transporte de líquidos, la adherencia mecánica o la interacción con células adyacentes. La Fig. 6.18 corresponde a una célula epitelial ideal que ilustra los distintos tipos de diferenciaciones.
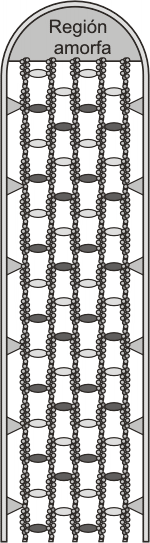
Fig. 6.17 - Distribución de los filamentos de actina en una microvellosida.
Microvellosidades
La superficie apical de la célula se proyecta en delgadas prolongaciones denominadas microvellosidades (fig. 6.19). Estas son muy abundantes en el epitelio intestinal en el que aumentan la superficie efectiva de absorción considerablemente. Cada célula puede tener hasta 3000 microvellosidades de 0,6 a 0,8 m de longitud. Las recorren internamente finos filamentos de actina.
Uniones Intercelulares
En organismos multicelulares, virtualmente toda célula actúa en íntimo contacto con sus vecinas y con componentes de la matriz extracelular. Tales interacciones ocurren de varias formas y se inician luego de la fertilización. De hecho, el proceso de embriogénesis puede en algún sentido ser resumido, como un complejo y exquisitamente orquestado juego de agrupamientos en diferentes poblaciones celulares. Desde el inicio, las interacciones específicas célula - célula y célula - matriz son necesarias para que el mantenimiento de la integridad epitelial y la producción de la respuesta imflamatoria ante una agresión, entre muchos otros procesos. La ruptura de los contactos celulares es incompatible con la supervivencia y es un signo característico en la patogénesis del cáncer y de los estados de deficiencia inmunes.
Las moléculas de adherencia celular y las uniones intercelulares son las dos razones por las que las células actúan recíprocamente y con su ambiente extracelular. Algunas de las proteínas de adherencia de las células son componentes de las uniones intercelulares. En casi todos los tipos de uniones, dichas moléculas relacionan superficies de membrana contiguas y terminan fijando a las células al citoesqueleto.
Las uniones intercelulares son clasificadas típicamente en tres grupos que varían físicamente en su composición molecular y apariencia ultrastructural y funcionalmente en la relación que establecen entre células adyacentes.
· En las uniones estrechas , oclusivas o zona ocludens se unen células epiteliales formando una capa continua que restringe la permeabilidad.
· Los Desmosomes, hemidesmosomes y uniones adherentes fijan células entre si y con la matriz extracelular, contribuyendo a la formación y mantenimiento de los tejidos.
· Las uniones del hendidura, comunicantes, uniones gap o nexus forman poros entre células que permiten el acoplamiento químico y/o eléctrico facilitando la comunicación intercelular.
Mientras que las moléculas de adherencia celular son un grupo de proteínas que como su nombre lo indica, unen flojamente a manera de un "Velcro" a células vecinas, constituyen un preludio necesario al establecimiento de las uniones intercelulares que proporcionan áreas más fuertes de contacto, a manera de "cierres" y "remaches".
Uniones estrechas
Los epitelios son hojas celulares que separan dos compartimientos actuando como una barrera selectivamente permeable entre ellos. El epitelio del intestino delgado, por ejemplo, separa el lumen del intestino del lecho vascular y permite sólo que determinadas moléculas puedan ingresar del lumen a la sangre. Las uniones estrechas "pegan" de manera individual a las células vecinas manteniéndolas juntas dentro de la misma capa de epitelio (Fig. 6.18). Las moléculas e iones del lumen deberán atravesar las células del epitelio (vía transcelular) o difundir a través de las uniones (vía paracelular).
La barrera de permeabilidad de un epitelio es definida por dos características de las uniones estrechas:
a) Estas uniones impiden a la mayoría de las moléculas cruzar el epitelio entre las células. El agua puede difundir a través ellas, pero la mayoría de los iones y incluso las moléculas pequeñas, como azúcares simples y aminoácidos no pueden ingresar.
b) Mantienen la asimetría de la membrana en las células epiteliales, que es una condición necesaria para el transporte transcelular. En las células de los epitelios polarizadas, la composición de la membrana celular que enfrenta un compartimiento es diferente a la que enfrenta al otro . Estas dos caras normalmente se llaman apical y basolateral. Las uniones estrechas abrazan las células y funcionan como un cerco para prevenir la difusión de proteínas entre los compartimientos apical y basolateral contribuyendo a mantener la asimetría. Esto es importante porque permiten el transporte vectorial (en un sentido) de moléculas a través de los epitelios. Por ejemplo, se transporta glucosa del lumen del intestino delgado a la sangre, pero nunca de la sangre al lumen. Esto es porque los transportadores de glucosa en la membrana apical (en contacto con el lumen) transportan dentro de la célula, mientras otros transportadores en la basolateral (enfrentados al capilar) transportan fuera de la célula. Si ambos tipos de transportadores estuvieran presentes en ambas membranas, no se absorbería glucosa eficazmente del lumen a la sangre.
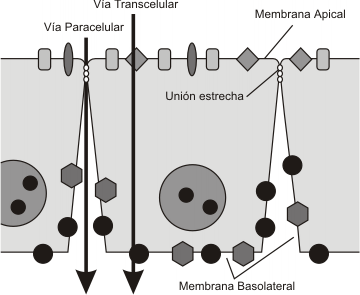
Fig. 6.18 - Uniones estrechas y asimetría de membrana
Estructuralmente, estas uniones son regiones de contacto célula-célula muy íntimo. La hoja de plástico que une las latitas de gaseosa es un análogo de esta estructura. Observando al ME, se ven las uniones estrechas como regiones de membrana celular que se tocan o incluso se funden sin espacio intercelular discernible .
La naturaleza molecular de la unión es poco conocida. Recientemente se purifico una proteína integral que forma parte de las mismas, la ocludina. Las ocludinas de las membranas de células contiguas se adhieren firmemente entre si, y generalmente se encuentran en grupos, formando una hilera de dos o tres uniones estrechas paralelas.
También se observan uniones similares en todas las células que forman revestimientos en órganos internos como la vejiga.
Uniones de anclaje: Desmosomas, hemidesmosomas y uniones adherens
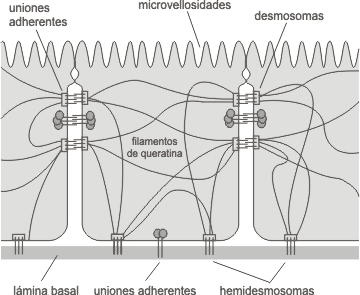
Fig. 6.19 - Uniones de anclaje en un epitelio
Las células que conforman tejidos y órganos deben fijarse entre si y a la matriz extracelular. Para tal fin, han desarrollado varios tipos de complejos de unión, y en cada caso, diferentes proteínas transmembrana se extienden a través de la membrana celular uniendo proteínas del citoesqueleto de una célula con proteínas del citoesqueleto de su vecina.
Se observan tres tipos de uniones, y difiere entre si por la proteína del citoesqueleto a la que se unen, así como por la proteína transmembrana .
Las uniones de anclaje no sólo mantienen las células juntas, también proporcionan cohesión estructural a los tejidos. Estas uniones son muy abundantes en los tejidos que están sujeto a tensión mecánica constante como la piel y el miocardio.
|
Uniones de Anclaje |
Proteína del citoesqueleto |
Proteína transmembrana |
Ejemplos |
|
Desmosomas |
Filamentos intermedios |
Cadherina |
Otras células |
|
Hemidesmosomas |
Filamentos intermedios |
Integrinas |
Matriz extracelular |
|
Uniones adherentes |
Filamentos de actina |
Cadherinas e Integrinas |
Otras células |
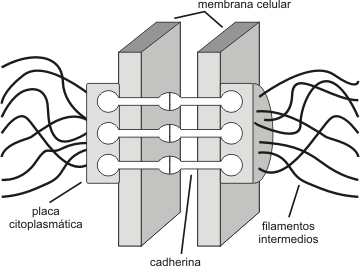
Fig. 6.20 - Estructura del desmosoma
Desmosomas
Los desmosomas puede visualizarse a manera de remaches a través de la membrana de células adyacentes. Están compuestos por glicoproteínas integrales de la familia de las cadherinas, cuyos dominios extracelulares se unen con iguales dominios de células vecinas. Por sus dominios citosólicos se fijan a filamentos intermedios compuestos de queratina y desmina. Esta última unión es mediada por proteínas de unión asociadas a la membrana o ligadoras, que forman un placa densa en la cara citoplasmática de la membrana. Las moléculas de cadherina forman un ancla que extendiéndose a través de la membrana se fija a la placa y a la vez se liga fuertemente a las cadherinas que se proyectan sobre la membrana de la célula adyacente.
El número de desmosomas es proporcional al grado de tensión que soporta un tejido.
Uniones adherentes, cinturón adhesivo o zonula adherens
Las uniones adherentes comparten la característica de fijar células a través de componentes del citoesqueleto, en este caso los filamentos corticales de actina. De manera similar a los desmosomas y hemidesmosomas, sus proteínas transmembrana son cadherinas, cuando se unen a otras células e integrinas, cuando la unión es a la matriz extracelular.
Los filamentos de actina que forman parte de las uniones adherentes son proteínas contráctiles que además poseen función de fijación.
Se piensa que las uniones adherentes participan plegando y doblando las hojas de los epitelios.
Uniones en hendidura, uniones comunicantes, uniones gap o nexus
En contraste con las uniones estrechas y las adherentes, las uniones en hendidura no sellan céluas entre si, ni restringen el pasaje de material entre las células. Más bien, este tipo de uniones esta compuesta de series de cauces pequeños que permiten el pasaje de pequeñas moléculas a través de ellos. Las uniones en hendidura permiten el acoplamiento eléctrico y metabólico entre las células, porque la señal iniciada en una célula puede propagarse rápidamente a las células vecinas. En general, el límite superior para el pasaje a través de las uniones en hendidura es de 1000 daltons (Da). Además de los iones, los ejemplos importantes de moléculas que pasan incluyen AMPcíclico (329 Da), glucosa-6-fosfato (259 Da) y nucleótidos (250-300 Da).
Se observan al ME como parches de tamaño variable, donde las membranas celulares de las dos células implicadas en la unión, están separadas por un espacio uniforme de 2-3 nm . En el espacio se observan tubos hexagonales llamadas conexones que forma poros acuosos de 2 nm de diámetro entre las dos células.
La proteína del conexón es la conexina que, cuando se expresa en células que normalmente no tienen uniones en hendidura, les permite formarlas. Se ven especies diferentes de conexinas entre organismos diferentes y entre los distintos tejidos de un organismo. Sin embargo, todos las conexinas comparten una estructura común. Poseen cuatro dominios transmembrana, estando los extremos amino y carboxilo en la cara citoplasmática. La fosforilación del dominio contiguo al extremo carboxilo, provoca el cierre del conexón, al modificar la disposición de las conexinas. Un conexón esta formado por seis moléculas del conexina que se extienden fuera de la célula a distancia uniforme. La alineación de los conexones de cada célula provoca la formación de los poros que funcionalmente definen esta unión.
Las uniones en hendidura son estructuras dinámicas, porque los conexones pueden abrirse y cerrarse independientemente. Se cierran cuando la concentración intracelular de calcio se eleva o desciende el pH intracelular. Esta autonomía funcional del conexón de una célula dentro de un grupo de células, permite el cierre de las uniones en hendidura en una célula dañada aislándola eficazmente y previniendo la extensión de la lesión.
Se ven estas uniones en virtualmente todas las células. Algunos ejemplos representativos de su importancia fisiológica incluyen:
Acoplamiento eléctrico: Las uniones en hendidura son abundantes en el músculo cardíaco y liso. La despolarización de un grupo de células musculares rápidamente se extiende a las células adyacentes, causando contracciones coordinadas de todo el músculo.
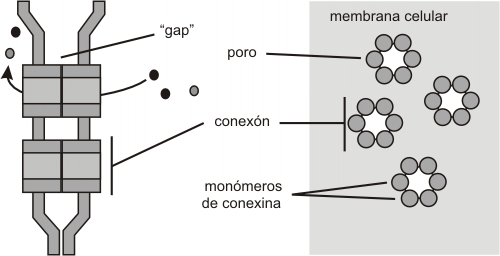
Fig. 6.21 - Unión en hendidura o nexus
Acoplamiento metabólico: Muchas hormonas actúan elevando las concentraciones intracelulares de AMP cíclico, que inicia una vía de señalización dentro de la célula. El AMP cíclico rápidamente pasa a través de las uniones en hendidura y así, el estímulo hormonal en una célula puede propagarse a un grupo de células .
Plasmodesmos
Las células vegetales a diferencia de las animales, carecen de uniones especializadas. Sin embargo, se conectan entre si por medio de conductos cilíndricos, llamados plasmodesmos. Estos plasmodesmos se extienden entre células contiguas a través de la pared celular. El interior del plasmodesmo se encuentra revestido por membrana plasmático y contiene un desmotúbulo, especie de varilla densa derivada del retículo endoplasmático liso. Solo son permeables a las moléculas de pesos inferiores a los 1000 Da, las cuales se mueven en el espacio delimitado entre la membrana periférica y el desmotúbulo central.
Los plasmodesmos son sitios de comunicación, permitiendo la integración metabólica en los tejidos vegetales
Citosol o matriz citoplasmática
El citosol, hialoplasma o matriz citoplasmática, consiste fundamentalmente en un sistema coloidal con grandes biomoléculas como lo son las proteínas, los polisacáridos y los ácidos nucleicos.
Sin embargo no debemos olvidar que también es una solución acuosa que tiene disueltos iones orgánicos e inorgánicos y pequeñas moléculas como monosacáridos, aminoácidos, pequeños ácidos orgánicos, etc.
En esta matriz tienen lugar muchísimos procesos metabólicos, por tal motivo entre las biomoléculas encontramos muchas enzimas, como las que participan en el proceso de glucólisis o el de síntesis de las proteínas. Para éste último, son imprescindibles los ribosomas, organoides también presentes en el citosol de todas las células y en el estroma o matriz de cloroplastos y mitocondrias.
En resumen podemos asegurar que el citosol no debe ser considerada una matriz amorfa y que además contiene elementos muy variados, la mayor parte de ellos importantes para el mantenimiento de la vida.
|
Elementos del citosol en eucariotas |
· Componentes del citoesqueleto |
|
· Enzimas |
|
|
· Moléculas de señalización |
|
|
· Maquinaria de la síntesis proteíca (ribisomas, ARNm.ARNt, etc. |
|
|
· Proteosomas |
|
|
· Chaperonas |
|
|
· Inclusiones, etc. |
A continuación daremos una breve descripción de algunos de estos componentes.
Inclusiones
Generalmente corresponden a la acumulación citoplasmática de diferentes tipos de sustancias en grandes cantidades. Podemos mencionar a los glicosomas que corresponden a la acumulación de glucógeno, como así también las gotitas de grasa comunes en los hepatocitos, en fibras musculares estriadas y en las células secretoras de leche.
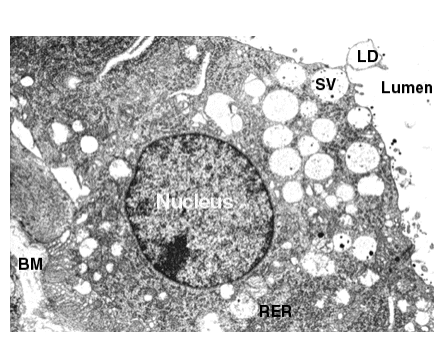
Fig. 6.22 - Microfotografía de célula secretora apócrina de alvéolo mamario. BM, membrana basal, RER, retículo endoplasmático rugoso; SV, vesícula secretora; LD, gota de lípido.
En algunos tipos celulares el citosol contiene pigmentos fabricados por la misma célula o provenientes del exterior. Por ejemplo la lipofuscina, de color marrón, constituida por fosfolípidos y proteínas. También encontramos cristales de proteínas cuya función todavía no es del todo conocida.
Ribosomas
Como ya lo indicáramos estos organoides están presentes en todos los tipos celulares y su estructura será descripta oportunamente.
Debemos señalar que, con excepción de algunas proteínas mitocondriales que se sintetizan en los ribosomas de la matriz mitocondrial, todas las proteínas se sintetizan en el citoplasma, y en el proceso intervienen siempre los ribosomas. Sin embargo, a pesar de la ubicación del proceso, no todas las proteínas permanecen en el citoplasma.
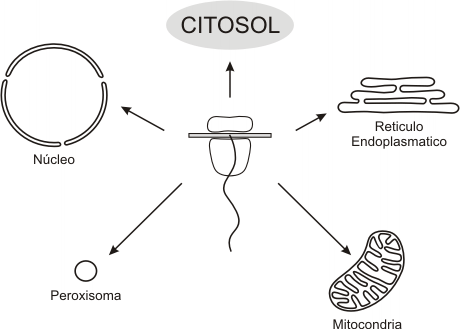
Fig. 6.23- Destino de las proteínas en los ribosomas citosólicos
El tránsito de proteínas desde el citosol hasta los diferentes destinos, requiere como ya hemos mencionado de un sistema de señalización preciso, que asegure la llegada de las proteínas al lugar adecuado. Estas señales se encuentran en la mismas proteínas. Como ejemplo podemos mencionar al péptido señal y las señales de anclaje (ver Sistema de endomembranas). Obviamente las proteínas destinadas al citosol no necesitan señales.
Chaperonas
Las chaperonas asisten a las proteínas para su oportuno y adecuado plegamiento. Son proteínas que aumentan durante los “estrés térmico” y en condiciones de estrés metabólico, siendo estas situaciones que producen la desnaturalización de un gran número de proteínas. Las chaperonas ayudan a la renaturalización de las proteínas afectadas. Como ejemplo mencionaremos a las chaperonas HSP60 y HSP70 (por las iniciales de Heath Shock Protein). Ambas chaperonas consumen energía para realizar su tarea. (Fig. 6.24).
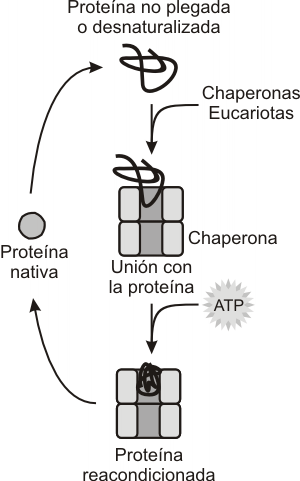
Fig. 6.24 - Modelo de la actividad reparadora de las chaperonas sobre las proteínas desnaturalizadas
Proteasomas
Podríamos decir que los proteasomas desempeñan funciones opuestas a los ribosomas, pues se encargan de la degradación de las proteínas endógenas dañadas (por ej. Factores de transcripción, ciclinas, proteínas codificadas por ADN viral o proteínas mal plegadas), obteniéndose de este modo oligopéptidos.
Los proteosomas están formados por un complejo enzimático, de más de una docena de proteínas diferentes, que se organizan en cuatro anillos apilados, que limitan una cámara central. En ambos extremos de este canal, se localiza la partícula regulatoria, formada por diferentes ATPasas y los varios sitios de reconocimiento de la proteína ubiquitina.
Las proteínas dañadas, que han cumplido su ciclo dentro de la célula, o que se plegaron inadecuadamente son marcadas con ubiquitina, una pequeña proteína de 76 aminoácidos, altamente conservada y virtualmente idéntica en secuencia en bacterias, levaduras y mamíferos.
La proteína ubiquitinizada, es reconocida por la partícula regulatoria del proteosoma. La proteína pierde su plegamiento por la acción de las ATPasas, con gasto de energía. La proteína desenrollada es translocada dentro de la cámara central, donde las proteasas la degradan. Se producen oligopéptidos de aproximadamente 8 aminoácidos de longitud. La partícula regulatoria libera la ubiquitina para ser nuevamente utilizada.
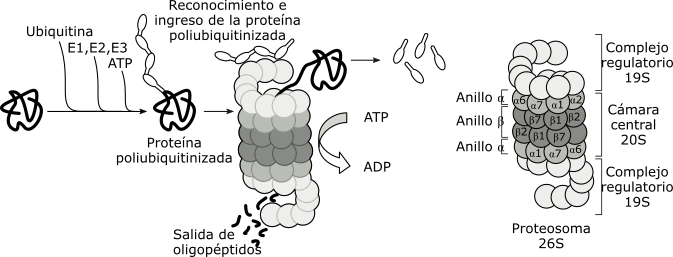
Fig. 6.25 - Modelo de la actividad de un proteosoma sobre las proteínas dañadas
AutoevaluaciÓn
1) Los componentes del citoesqueleto que se relacionan con los estados SOL-GEL del citosol son:
a- Los filamentos intermedios
b- Los microfilamentos de actina
c- Los microfilamentos de miosina
d- Los microtúbulos
2) La actina de los microfilamentos:
a- Es una proteína fibrilar
b- Es una proteína globular
c- No es una proteína
d- Se contrae activamente
3) Los filamentos intermedios están formados principalmente por:
a- Desmina
b- Vimentina
c- Desmina y vimentina
d- Queratina
4) -¿Cuál de las siguientes NO es función de los microtúbulos?:
a- formar el axonema de cilios y flagelos
b- intervenir en el transporte vesicular
c- participar en la emisión de lamelipódios
d- formar cuerpos basales
5) la proteína asociada con el movimiento ciliar es:
a- la dineína
b- la queratina
c- la vimentina
d- la tubulina
6) El citosol es:
a- El espacio comprendido entre la membrana plasmática y el núcleo
b- El medio interno celular, que rellena los espacios existentes entre compartimientos
c- El conjunto de organelas de la célula y el medio que las rodea
d- El medio interno de la célula, metabólicamente inerte
7) En las células animales la comunicación entre las células vecinas se establece a través de:
a- nexus o uniones gap
b- desmosomas
c- plasmodesmos.
d- hemidesmosomas
8) La principal función de las microvellosidades es:
a- aumentar la superficie celular
b- actuar como barrera a la difusión entre células
c- aumentar la adherencia entre células de un mismo tejido
d- aumentar la hermeticidad en los tejidos epiteliales
9) En el transporte de vesículas con neurotransmisores desde el cuerpo de la neurona hasta el final del axón, participan:
a- microtúbulos y dineína
b- microtúbulos y quinesina
c- filamentos de actina
d- filamentos intermedios
10) La matriz extracelular y el citoesqueleto tienen en común:
a- Estar constituidos por proteínas fibrosas que son polímeros de tubulina.
b- Estar constituidos por colágeno y proteoglucanos.
c- Estar relacionados funcionalmente en la migración celular.
d- Estar relacionados funcionalmente en la respiración celular
11) Las membranas basales se caracterizan por presentar un alto contenido de:
a- colágeno tipo I
b- colágeno tipo II
c- colágeno tipo IV
d- colágeno tipo V
12) Los proteoglucanos de la matriz extacelular son moléculas:
a- polianiónicas e hidrofóbicas
b- polianiónicas e hidrofílicas
c- policatiónicas e hidrofóbicas
d- policatiónicas e hidrofílicas
13) Las partículas regulatorias del proteosoma:
a- carecen de complejos enzimáticos
b- presentan todas las proteasas del proteosoma
c- libera la ubiquitina
d- es el sitio de la ubiquitinazión
14) Las chaperonas sirven para:
a- promover el plegamiento de las proteínas
b- etiquetar las proteínas que serán degradadas
c- eliminar ribosomas del RER
d- activar enzimas del aparato de Golgi
Bibliografía
· Alberts, B. et al; (1996) Biología Molecular de la Célula; 3° Edición; Ediciones Omega S.A. Barcelona.
· Karp, G.; (1998) Biología Celular y Molecular; Ed. Mc Graw Hill Interamericana. México.
· De Robertis (h), Hib, Ponzio; (1996) Biología Celular y Molecular de De Robertis; 12° Edición; El Ateneo. Bs.As.
· De Robertis,E; Hib,J.; (1998) Fundamentos de Biología Celular y Molecular; El Ateneo. Bs.As.
· Fuchs, E. And Cleveland, D. A Structural Scaffolding of Intermediate Filaments in Health and Disease , Science 279: 514-519 (1998).
· Hirokawa, N. Kinesin and Dynein Superfamily Proteins and the Mechanism of Organelle Transport. Science 279: 519-526 (1998).
· Smith and Wood; (1997) Biología Celular; Ed. Addison-Wesley, Iberoamericana S.A.
· Wickner, S; Maurizi, M. and Gottesman, S. Posttranslational Quality Control: Folding, Refolding, and Degrading Proteins, Science 286: 1888-1893 (1999).
[1] Las integrinas están formadas por una subunidad alfa y una beta. En los humanos, se presenta una enfermedad de origen genético llamada "deficiencia adhesiva leucocitaria". Los individuos afectados por esta enfermedad sufren de infecciones reiteradas, pues no sintetizan la subunidad beta de las integrinas, entonces sus leucocitos no pueden atravesar los endotelios e ingresar en los tejidos para cumplir con su función de defensa.